Заключение о развитии ребенка в антенатальном периоде
Антенатальный период (латинский ante – перед и natalis – относящийся к родам) – период внутриутробного развития плода от момента образования зиготы до 40 недель. Антенатальный период условно делят на 2 периода: эмбриональный и фетальный, состоящих из определенных этапов, по которым совершается непрерывное развитие организма. Каждому этапу присущи свои особенности биохимических процессов и функций нейрогуморальной регуляции и взаимодействия отдельных систем организма плода.
В эмбриональном периоде (от момента образования зиготы и до 12 недель) происходит закладка и дифференцировка тканей, стремительное первичное становление их функций, формирование частей тела и внутренних органов (см. Зародыш, Эмбриональное развитие). У 8-недельного эмбриона сформированы голова, туловище, конечности, начинается развитие пальцев рук и ног, лицевого скелета; можно различить нос, рот, уши. В этот период начинает функционировать сердце. Фетальный период делится на ранний и поздний антенатальный и интранатальный. Ранний антенатальный период длится от начала 12-й до 29-й недели внутриутробной жизни. К этому времени большинство органов плода уже сформировано. Поздний антенатальный период продолжается от 29-й недели внутриутробной жизни до начала родов. В течение 38-40 недель признаки зрелости плода (см. Доношенность) достигают полного развития.
Согласно теории системогенеза П. К. Анохина в процессе внутриутробного развития плода происходит ускоренное избирательное становление всех тех структур и связей, совокупность которых обеспечивает развитие к моменту рождения функций, необходимых ребенку для существования во внеутробной среде(см. Системогенез).
От того, как протекал антенатальный период, благоприятно или неблагоприятно для плода, зависит состояние ребенка после рождения, его адаптация к внеутробному существованию, характер возможной патологии.
В процессе внутриутробного развития различают периоды, которые получили название критических (П. Г. Светлов, 1959). К ним относятся период имплантации (7-12-й день) и период образования зачатков органов (3-6-я неделя беременности). К критическому периоду относят также 3-й месяц беременности, в течение которого заканчивается формирование плаценты и ее функции достигают высокой степени активности. В этот период происходят существенные изменения в жизни плода. Появляются новые рефлексы, образуются зачатки коры головного мозга; происходит формирование костномозгового кроветворения, появляются в крови лейкоциты; повышается активность и интенсивность обмена веществ.
В. И. Бодяжина предлагает различать еще один критический период в течении внутриутробной жизни плода (20-24-я неделя). В это время происходит формирование важнейших функциональных систем плода. Знание особенностей этих периодов составляет одну из сторон антенатальной охраны плода (см.). При действии повреждающих факторов среды особенно легко нарушаются характер и направленность процессов обмена, типичных для данного критического периода развития. В связи с этим возникают нарушения эмбриогенеза, которые могут носить необратимый характер (см. Антенатальная патология).
Антенатальное формирование ферментативных систем
Развивающийся эмбрион для своего развития, роста, дифференциации тканей, осуществления специальных функций требует большого количества энергии. Источником энергии являются процессы окисления. У плодов функционируют системы цикла Кребса, Эмбдена-Мейергофа, Варбурга-Кейлина. Для совершения этих процессов необходимо 20-30 различных энзимов, несколько коэнзимов, причем возникновение этих коэнзимов и энзимов сочетается с периодами наиболее интенсивного роста органов, и появление ферментов строго специфично. Цитохромоксидаза появляется вместе с началом формирования дыхательной системы. Запасы гликогена как источника энергии появляются вначале в плаценте и легких плода. В печени гликоген депонируется на 12-15-й неделе беременности. К 20-24 неделям печень становится единственным органом утилизации гликогена и берет на себя функции регуляции уровня глюкозы в крови. Фермент глюкозо-6-фосфатаза обнаруживается после 10-й недели беременности в печени. На сроке 15 недель этот фермеш находят в почках.
В период дифференциации тканей щелочная фосфатаза достигает максимума. Этот фермент имеет отношение к образованию примордиального фолликула. Мак-Кей (McKay) обнаружил наибольшую активность этого фермента в период формирования нервной трубки, желудочно-кишечного тракта,печени. В наибольшем количестве этот фермент находят в тканях, где идет наиболее активный процесс синтеза новых белков из нуклеиновых кислот. Чрезвычайно важно исследование фермента карбоангидразы, принимающего активное участие в регуляции кислотнощелочного равновесия у плода. Мнения по поводу активности этого фермента противоречивы. Г. М. Савельевой выявлена низкая активность этого фермента у плодов без признаков гипоксии. Автор объясняет это преобладанием процессов анаэробного гликолиза в обмене плода. При выраженной гипоксии плода увеличение количества недоокисленных продуктов обмена приводит к возрастанию активности карбангидразы. Это зависит от компенсаторной реакции организма, направленной на уменьшение ацидоза за счет усиленного выделения углекислоты. В печени имеется целый ряд ферментов, осуществляющих биосинтез и метаболизм стероидов: 3-бета- стеропддегидрогеназа, 20-альфа – гидроксистероиддегидрогеназа. Эти ферменты появляются на 25-й неделе беременности. Печень плода очень активна в отношении конъюгации стероидов с серной кислотой, под влиянием фермента сульфокиназа. В яичках плодов мужского пола обнаружен полный спектр активных энзимных систем для биосинтеза стероидных гормонов.
Система нейрогуморальной регуляции плод – плацента – мать
Развитие и совершенствование функций органов и систем плода находятся под многообразным влиянием процессов, происходящих как в организме матери, так и в самом плоде, то есть внутриутробная жизнь плода совершается в единой нейро-эндокринной системе плод – плацента – мать.
Плацента (см.) является главным органом образования прогестерона, который синтезируется путем превращения материнского холестерола. Плацентарный прогестерон поступает к плоду, где он широко метаболизируется и используется для синтеза стероидов в надпочечниках плода. На разных уровнях развития плода, по мере созревания и вступления в строй энзимных систем, надпочечники плода синтезируют различные гормоны. Так, плод менее 10 мм длиной вырабатывает андростендион, 11-бета-андростендион, дезоксикортикостерон, кортикостерон, кортизол. Однако главным гормоном является андростендион. Плод более 10 мм длиной вырабатывает в большей степени кортизол и кортикостерон и меньше андростендиона. Уровень образования этих стероидов зависит от концентрации в плазме прогестерона, поступающего от матери, и концентрации тройных гормонов. Деятельность надпочечников плода находится под влиянием АКТГ, выделенного его гипофизом. Относительная недостаточность ферментов 21-гидроксилазы, 3-бета-олстеро-иддегидрогеназы создает условия, при которых надпочечники плода имеют затруднения в синтезе активных глюкокортикоидов и минерало-кортикоидов. Этот механизм, по мнению Шорта (R. V. Short), является важным, так как позволяет плоду быть целиком под контролем гомеостазиса матери, получая активные стероиды, углеводы, электролиты через плаценту.
Деятельность надпочечников плода очень важна для поддержания нормального гормонального статуса во время беременности. Обладая 17-альфа и 16-гидроксилазной активностью уже на сроке 15 недель беременности, надпочечники плода человека синтезируют дегидроэпиандростерон, из которого в плаценте синтезируется эстриол. И по уровню последнего в моче и крови матери судят о жизнеспособности плода.
Тесная взаимосвязь надпочечников плода с функционированием плаценты и материнскими эндокринными органами может нарушаться при патологии плода или матери. От состояния и адекватной регуляции обменных процессов, происходящих во время беременности в организме матери, в равной степени в плаценте и в плоде, зависит течение антенатального и постнатального периодов.
Библиография: Клосовский Б. Н. и Космарская Е. Н. Передача заболеваний от матери к ребёнку в эмбриогенезе по принципу «орган к органу» и вопросы профилактики, в кн.: Антенатальная охрана плода, под ред. М. С. Малиновского, с. 208, М., 1968; Пути снижения перинатальной смертности, под ред. В. И. Бодяжиной и Л. К. Скорняковой, М., 1964.
В. А. Таболин, Л. И. Лукина.
Источник
Дзилихова К.М. 1 Церекова А.А. 1 Калоева З.Д. 1 Дзгоева З.Г. 1 Чихтисова Р.А. 1 Хатагова М.Ю. 1
1 ФГБОУ ВО «Северо-Осетинская государственная медицинская академия» Минздрава РФ
Изучены особенности течения беременности, родов у женщин, страдающих первичной артериальной гипотензией (ПАГ), и влияние сниженного системного АД на процесс внутриутробного развития плода и особенности неонатального периода развития детей, рожденных от матерей с ПАГ. Установлен значительный вклад артериальной гипотензии в механизмы нарушений кровообращения в системе «мать – плацента – плод», снижение показателей физического развития новорожденных детей, нарушение их адаптации в раннем неонатальном периоде. Полученные результаты свидетельствуют о необходимости раннего внедрения комплекса превентивных мероприятий для беременных с ПАГ, включающих коррекцию гемодинамических расстройств, как у матери, так и у плода, а также, в дальнейшем, с момента рождения ребенка применения эффективных диспансерных программ для обеспечения его гармоничного развития.
первичная артериальная гипотензия
беременность
новорожденные дети.
1. Агапитов Л.И., Балева Л.С., Белозеров Ю.М. Кардиология детского возраста / Л.И. Агапитов, Л.С. Балева, Ю.М. Белозеров. – Москва: ГЭОТАР-Медиа, 2014. – 775 с.
2. Архипова Н.Н. Артериальная гипотензия у детей и подростков /Н.Н. Архипова // Практическая медицина. – 2008. – 28(4). – С. 63-65.
3. Брязгунов И.П. Первичная артериальная гипотензия у детей и подростков /И.П. Брязгунов // Вопросы современной педиатрии. – 2003. – 2(3). – С.68-71.
4. Кудина Е.В., Рачек И.И., Ларина В.Н. Артериальная гипотензия: диагностика, немедикаментозные и медикаментозные методы лечения / Е.В. Кудина, И.И. Рачек, В.Н. Ларина // Лечебное дело. – 2015. – № 2. – С.4-9.
5. Лыткин В.А., Эверт Л.С. Вазовагальные и ортостатические обмороки у детей и подростков /В.А. Лыткин, Л.С. Эверт // Сибирское медицинское обозрение. – 2011. – 67(1). – С.106-109.
6. Кудина Е.В., Ларина В.Н. Тактика ведения женщин с артериальной гипотензией в зависимости от клинического варианта / Е.В. Кудина, В.Н. Ларина // Проблемы женского здоровья. – 2015. – 10(3). – С.66-70.
7. Ляличкина Н.А. Влияние уровня эндогенной интоксикации на формирование плацентарной недостаточности у беременных с артериальной гипотонией /Н.А. Ляличкина // Фундаментальные исследования. – 2013. – 3(2). – С.329-331.
8. Шиляева Н.С., Максимова Ю.В., Макаров К.Ю. Изменение артериального давления во время беременности /Н.С. Шиляева, Ю.В. Максимова, К.Ю. Макаров // Медицина и образование в Сибири. – 2008. – № 5. – С. 11.
9. Fischer, W.M. Stude I., Brandt H. Ein vorschlag zur Beurteilung des antepartalen Kardiotokogramms // Z. Geburtsh. Perinat. – 1976. – Bd. 180. – Р.117-123.
10. Vintzileos A.M., Campbell W.A., Ingardia C.J., Nochimson D.J. The fetal biophysical profile and its predictive value // Obstet Gynecol. – 1983. – № 62. – Р.271-274.
Первичная артериальная гипотензия (ПАГ), по сведениям из различных информационных источников, в популяции детей и подростков встречается от 9 % до 17 %, характеризуется значительной дисфункцией вегетативно-эндокринных влияний, признана весомым фактором риска возникновения атерогенных сдвигов, выявлены нарушения в функционировании многих физиологических систем. Однако при этом остаются неуточненными многие проблемы: влияние наследственных факторов на формирование и патогенез болезни, клинические проявления в различные периоды детства и методы адекватной реабилитации гемодинамических расстройств [1-5].
Гемоциркуляторные расстройства, лежащие в основе многочисленных клинических проявлений заболевания, не могут не влиять и на функционирование детородных органов, знание особенностей их влияния особенно значимо в периоде антенатального развития ребенка и в процессе раннего постнатального онтогенеза [6-8].
Несмотря на наличие публикаций, посвященных влиянию ПАГ у беременной на особенности антенатального периода развития плода и возможность серьезной патологии в родах, генез выявляемой авторами осложнений остается изученным недостаточно.
Целью исследования являлось выявление особенностей течения антенатального и раннего неонатального периодов развития детей, рожденных от матерей с первичной артериальной гипотензией.
Материал и методы
Для решения поставленной цели проведены наблюдения за течением беременности и ее исходом у 125 беременных, из них 85 женщин с первичной артериальной гипотензией (I группа) и 40 соматически здоровых женщин контрольной группы с нормальными показателями АД. Возрастной состав беременных – от 18 до 38 лет, средний возраст – в группе с ПАГ – 22,8±7,6 лет, в группе контроля – 25,8±6,7 лет. Начало наблюдения – с момента поступления информации о беременной в детскую поликлинику.
Диагноз артериальной гипотензии у беременных обоснован терапевтом и кардиологом до беременности в результате длительного динамического наблюдения (9-12 лет), детального лабораторно-инструментального обследования, основан на наличии стабильно сниженных значений АД, характерной клинической картины и отсутствии сопутствующей патологии, влияющей на показатели системного АД.
В периоде беременности обследование включало: изучение генеалогического, биологического, социального и акушерского анамнеза; осмотр и инструментально-функциональные методы (ЭКГ, ЭхоКГ).
Помимо наблюдения за общесоматическим состоянием беременных, при сроках – 22-23 и 32-33 недели антенатального развития плода оценивалось допплерометрическим методом состояние маточно-плацентарно-плодового кровотока (аппарат Sonoace-4800, с допплеровским блоком фирмы «Медисон»), при этом в маточной артерии (МА), в артерии пуповины (АП) и в средней мозговой артерии (СМА) учитывали три основных индекса: СДО – систоло-диастолическое отношение, ПИ – пульсационный индекс, ИР – индекс резистентности.
Динамику роста плода, формирование плаценты оценивали методами ультразвуковой фетометрии и плацентографии, при этом определяли также количество околоплодных вод, двигательную активность плода, его дыхательные движения и тонус.
С 22 недели беременности методом наружной кардиотокографии (КТГ) при помощи кардиотокографа HP8041A «HewlettPackard» (США) исследовалось состояние сердечной деятельности плода. Оценивался нестрессовый тест с оценкой в баллах, по шкале W. M. Fisher [9]. На основании полученных результатов оценивали биофизический профиль плода по методике А.Vintzileos [10].
После родов под наблюдением находились 85 детей, родившихся у матерей с ПАГ -первая группа и 40 детей контрольной группы, рожденные от практически здоровых матерей.
Всем детям с использованием таблиц центильного типа была проведена оценка физического развития детей с оценкой степени нарушения, типа телосложения, пропорциональности.
Полученный фактический материал статистически обработан с применением стандартных программ математического обеспечения isticsforWindows 6.0. Достоверность межгрупповых отличий определяли соответственно критерию Стьюдента (р<0,05). Для уточнения тесноты связи между показателями проведен корреляционный анализ данных по Пирсону.
Результаты и обсуждение
У подавляющего большинства (75,3 %) женщин с первичной артериальной гипотензией АД во время беременности оставалось сниженным, примерно у каждой четвертой в I группе отмечалась нормализация или повышение АД на фоне гестоза. Все беременные с ПАГ, включенные в настоящее исследование, не получали сколько-нибудь регулярной терапии препаратами, повышающими АД.
Жалобы на общую слабость (85,9 %), повышенную утомляемость (80,0 %), нарушение сна (56,5 %), выявленные у беременных с ПАГ, часто провоцировались неблагоприятными метеофакторами, психоэмоциональными и физическими нагрузками. Течение первой половины беременности осложнялось токсикозом легкой и средней степени тяжести у 57,6 % беременных с ПАГ и 37,5 % женщин контрольной группы. Отягощенное гестозом течение второй половины беременности также выявлялось более часто у женщин с ПАГ в сравнении с контрольной группой, так отеки выявлены у 28,2 %, нефропатия – у 16,4 % беременных с ПАГ, в контрольной группе эти показатели составили соответственно 12,5 % и 2,5 % соответственно. Беременность сопровождалась угрозой преждевременных родов в первой группе – у 37,6 % наблюдаемых, и в контроле – в 5,0 % случаях. У 12,9 % наблюдаемых женщин с ПАГ и у 7,5 % здоровых беременных была выявлена гипохромная анемия.
На протяжении данной беременности, по результатам УЗИ, гипоксия плода отмечена в первой группе в 44,7 % случаев и в контроле у 12,5 % беременных, задержка внутриутробного развития плода по гипотрофическому типу выявлена только у женщин с ПАГ (10,6 %).
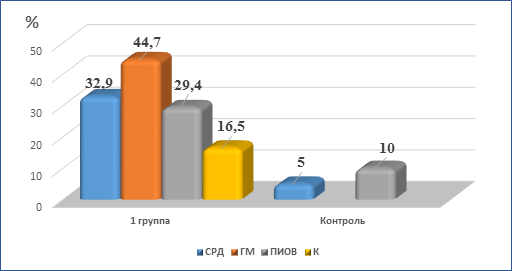
Наиболее частыми осложнениями в родах у беременных были слабость родовой деятельности, раннее отхождение околоплодных вод, гипотония матки, послеродовые кровотечениями. Так, слабость родовой деятельности наблюдалась у 32,9 % беременных первой группы и лишь у 5,0 % женщин в контроле. Преждевременное излитие околоплодных вод наблюдалось в три раза чаще при ПАГ (29,4 %), чем в контроле (10,0 %). Гипотония матки и кровотечения в послеродовом периоде выявлены лишь в группе беременных с ПАГ (рис.1).

Рис.1. Наиболее частые осложнения в родах у беременных с ПАГ
Примечание: СРД – слабость родовой деятельности; ГМ – гипотония матки; ПИОВ – преждевременное излитие околоплодных вод; К – кровотечения.
Полученные данные указывают на отрицательное влияние нарушений системной гемодинамики у беременных с ПАГ на характер течения беременности и родов.
Первое допплерометрическое исследование маточной гемодинамики на 21-22 неделе беременности выявило наличие патологического кровотока у многих беременных с ПАГ. Снижение интенсивности маточно-плацентарно-плодового кровотока IА степени при первичном исследовании наблюдалось в первой группе у 45,6 %, в контроле у 2,5 % беременных. Нарушение кровотока IБ степени выявлено у 18,8 % беременных с ПАГ, а в контроле лишь у 2,5 % женщин. Снижение интенсивности кровотока II степени в первой группе наблюдалось у 12,9 %, в группе контроля не было выявлено (рис. 2).
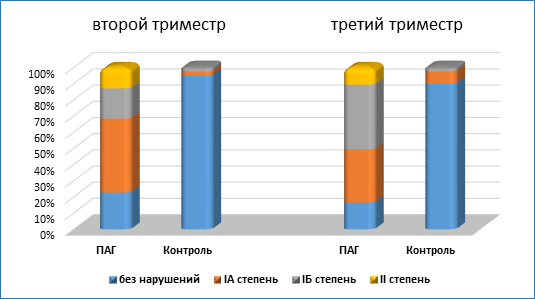
Рис. 2. Нарушение маточно-плацентарно-плодового кровотока во втором и третьем триместре у беременных с ПАГ
При допплерографическом исследовании на сроке 32-33 недели беременности снижение интенсивности маточно-плацентарно-плодового кровотока IА степени наблюдалось в первой группе у 32,9 %, в контроле у 7,5 % женщин; нарушение гемодинамики IБ степени отмечалось у 40,0 % беременных с ПАГ, в контроле лишь у 2,5 % обследованных. Снижение интенсивности маточно-плацентарно-плодового кровотока II степени в первой группе наблюдалось у 10,6 %, в группе контроля не выявлено (рис. 2).
Таким образом, с увеличением срока беременности отмечается ухудшение показателей плодово-плацентарного и маточно-плацентарного кровотока, особенно выраженное у женщин с ПАГ.
За последнее десятилетие при физиологическом течении беременности детально исследована динамика показателей маточно-плацентарного и фетоплацентарного кровотока, при этом выявлено постепенное снижение сосудистого сопротивления. Выявленная динамика объясняется повышением вместимости плодово-плацентарного круга кровообращения, изменением гормонального статуса матери и функциональной активностью желез внутренней секреции плода [7].
У обследуемых беременных с ПАГ физиологического снижения периферического сопротивления в маточной артерии выявлено не было, что, по-видимому, следует объяснять имеющимися нарушениями системной гемодинамики.
Для оценки биофизического профиля плодов была проведена кардиотокография (КТГ), которая во II триместре беременности выявила, что средняя частота сердцебиений плода в первой группе составляла 137,2±1,8 ударов в 1 мин., частота шевелений плода за 30 минут – 5,6±0,7, а в группе контроля эти показатели составили 148,3±0,8 и 7,8±0,7 соответственно (р<0,05). Оценка показателей КТГ в третьем триместре выявила, что средняя частота сердцебиений плода составляла 141,5±1,9 ударов в мин., частота шевелений плода за 30 минут – 6,1±0,5, а в группе контроля – 151,0±1,5 (р<0,05) и 7,4±0,8.
При балльной оценке КТГ при сроках 33-35 недель беременности показатели (базальный ритм ЧСС, амплитуда и частота осцилляций ЧСС, акцелераций, децелераций) в первой группе были достоверно ниже по сравнению с контрольной группой. Так, оценка в 6 баллов (по 10 балльной шкале Фишера) выявлена только в первой группе у 17,6 % обследованных. Оценка 7 баллов наблюдалась у 42,4 % беременных с ПАГ и у 15,0 % группы контроля. 8 баллов биофизического профиля плода зарегистрировано у 40,0 % беременных с ПАГ и у 75,0 % женщин группы контроля. Уровень, соответствующий 9 и 10 баллам в первой группе не выявлен, в контроле отмечен у 7,5 % и 2,5 % беременных соответственно.
Средние показатели массы, длины тела и окружности груди новорожденных детей, рожденных от матерей с ПАГ, были достоверно ниже, чем в контроле. Окружность головы у детей, рожденных от матерей с патологией, также имела несколько меньшие значения в сравнении с новорожденными контрольной группы (таблица).
Антропометрические показатели у обследованных новорожденных (М±m)
Группы Показатели | Первая группа n = 85 | Контрольная n = 40 |
Масса тела, г. | 3140,0 ± 58,6* | 3320,0 ±44,7 |
Длина тела, см. | 50,2 ± 0,7* | 53,8 ± 0,8 |
Окружность головы, см. | 32,7 ± 0,2 | 34,2 ± 0,3 |
Окружность груди, см. | 30,9 ± 0,5* | 33,1 ± 0,3 |
Примечание: * – статистическая достоверность различий по сравнению с контрольной группой (p< 0,05).
Достоверно более низкие показатели биофизического профиля плода, а также средних значений массы, длины тела, окружности груди при рождении у детей, свидетельствуют о неблагоприятном течении антенатального периода на фоне существенных нарушений маточно-плацентарно-фетальной гемодинамики у беременных с ПАГ.
В первой группе средняя оценка новорожденного по шкале Апгар составила 7,6±0,9 баллов, в контроле – 8,2±0,6 баллов.
Дезадаптационный синдром, отмеченный у 63,5 % новорожденных, родившихся у матерей с ПАГ, и у 12,5 % в контрольной группе, проявлялся выраженной потерей массы тела, медленным ее восстановлением, физиологической желтухой новорожденных и функциональной кардиопатией (приглушенность сердечных тонов, систолический шум, тенденция к брадикардии). Так физиологическая убыль массы тела более чем на 6,0 % в первой группе отмечена у 22,4 %, в контрольной – у 5,0 % новорожденных. Физиологическая желтуха выявлена в первой группе у 28,2 %, в контроле – у 5,0 % детей. Функциональная кардиопатия отмечена только у 17,6 % детей, рожденных у матерей с ПАГ.
Значимые корреляции отмечены у новорожденных между показателями индекса резистентности в артерии пуповины и значениями массы тела (r=+0,70) и роста (r=+0,69), значениями пульсационного индекса средней мозговой артерии и окружностью головы (r=+0,48) и груди (r=+0,57). Достоверные корреляционные зависимости выявлены между показателями САД матери и массой тела новорожденных (r=+0,65).
Заключение
Результатами данного исследования установлено неблагоприятное влияние сниженного системного артериального давления на течение беременности, родов и неонатального периода развития детей. Выявлено, что у женщин с ПАГ значительно более часто, чем в здоровой популяции беременных, отмечается патологическое течение беременности, нарушения кровообращения в системе «мать – плацента – плод», снижение показателей физического развития новорожденных, нарушение адаптации в раннем неонатальном периоде. Полученные результаты свидетельствуют о необходимости раннего внедрения комплекса превентивных мероприятий для беременных с ПАГ, включающих коррекцию гемодинамических расстройств, как у матери, так и у плода, а также, в дальнейшем, с момента рождения ребенка применения работниками первичного звена здравоохранения эффективных диспансерных программ для обеспечения его гармоничного развития.
Источник
