Внутриутробное развитие сердечной системы ребенка
11.07.201615:2011.07.2016 15:20:23
Врач ультразвуковой диагностики

«Сердце – оно источник наших чувств, увлечений, любви. Оно позволяет вкусить радость жизни.
Да, удивительный этот орган – сердце!»
(из анимационного сериала о строении тела человека для детей «Жила-была жизнь» ). Сердце – важнейший и сложный по строению физический орган человека.
Это обусловлено, с одной стороны его основными функциями для всего человеческого организма, с другой – обеспечивает широкое многообразие врожденных пороков развития.

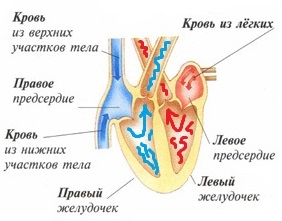
Из школьной программы по биологии мы помним, что сердце человека имеет 4 камеры (2 предсердия и 2 желудочка), выполняющего роль насосной функции. Правая половина (правое предсердие и правый желудочек) сердца собирает использованную бедную кислородом кровь и направляет в легкие. Левая половина (левое предсердие и левый желудочек) получает из легких оксигенированную кровь и посылает тканям и органам человека. Таким образом, благодаря сердцу поддерживается «часовой механизм» снабжения питанием органов и возврат использованной крови кислородом от органов в легкие. Формирование сердца уже начинается с ранних сроков беременности и на этапах эмбриогенеза выполняет свою основную функцию кровообращения плода. Эмбрионегез сердца представляет собой поэтапное строительство сердечных структур со 2 по 6 неделю беременности. Именно этот период является особенно чувствительным со стороны факторов риска развития врожденных пороков сердчечно-сосудистой системы малыша, которые мы разберём в нашей следующей статье.
Закладка сердца появляется у эмбриона в конце 2-й недели развития из простых 2-х сердечных трубок, которые сливаясь воедино, образуют общую сердечную трубку и кровь поступает одним сплошным потоком .
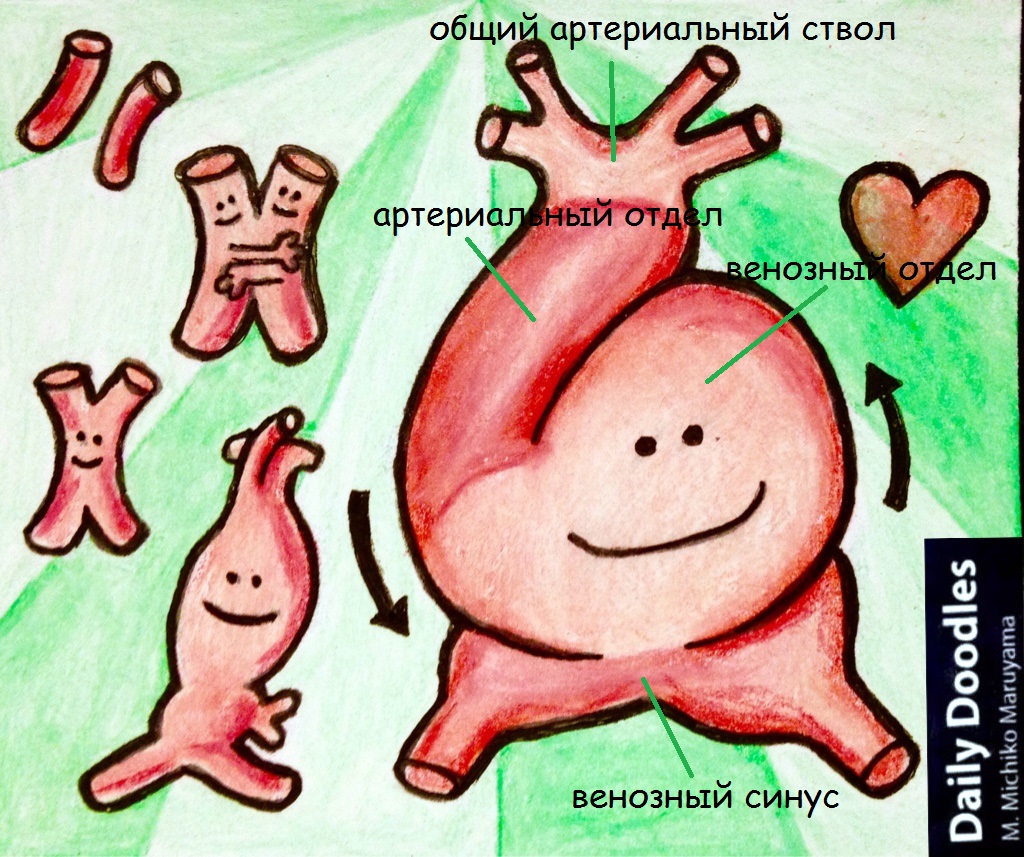
В конце 3-й – начале 4-й недели у эмбриона совершается неравномерный рост сердечной трубки и это приводит к изменению и усложнению формы. Образуется сигмовидное или S-образное сердце, в котором различают венозный синус, следующий за ним венозный отдел (первичный желудочек), артериальный отдел (первичное предсердие) и затем общий артериальный ствол. Сердце на этой стадии однокамерное и в этот период оно начинает сокращаться.
В дальнейшие стадии развития венозный и артериальный отделы сердца разрастаются, и между ними возникает глубокая перетяжка. Оба колена артериального отдела постепенно срастаются. Так формируется двухкамерное сердце эмбриона (4-я неделя развития ).
На этой стадии существует лишь большой круг кровообращения; малый круг складывается позже в связи с развитием легких. Дальнейшим этапом развития является образование межпредсердной перегородки (стадия трехкамерного сердца или 5-6 неделя развития).
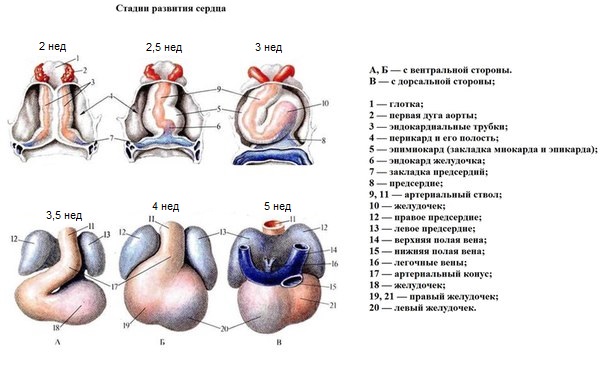
На 6-й неделе развития эмбриона происходит разделение желудочковой камеры посредством межжелудочковой перегородки, а также одновременно формируются клапаны и происходит разделение общего артериального ствола на аорту и легочную артерию (стадия четырехкамерного сердца).
На сроке в 6-7 недель, в уже практически “готовом” сердце заканчивается построение межжелудочковой перегородки, разделяющей правый и левый желудочек сердца.
Кровообращение плода имеет свои особенности в отличие от взрослых, так как дыхательная и пищеварительная системы внутриутробно практически не функционируют.
Итак, как же малышу удается обходиться без дыхания, печенек и вкусных булочек?

Все питательные вещества и кислород поступают с кровью матери путем вспомогательных приспособлений, к которым относится плацента, пуповина и фетальные коммуникации (венозный проток, овальное окно и артериальный проток).
Фетальные коммуникации – это сердечные структуры плода, с помощью которых кровь смешивается (в отличии от взрослых) и большая часть поступает в левые отделы, так как легкие не совершают газообмен. Давайте, подробно проанализируем, как это происходит.
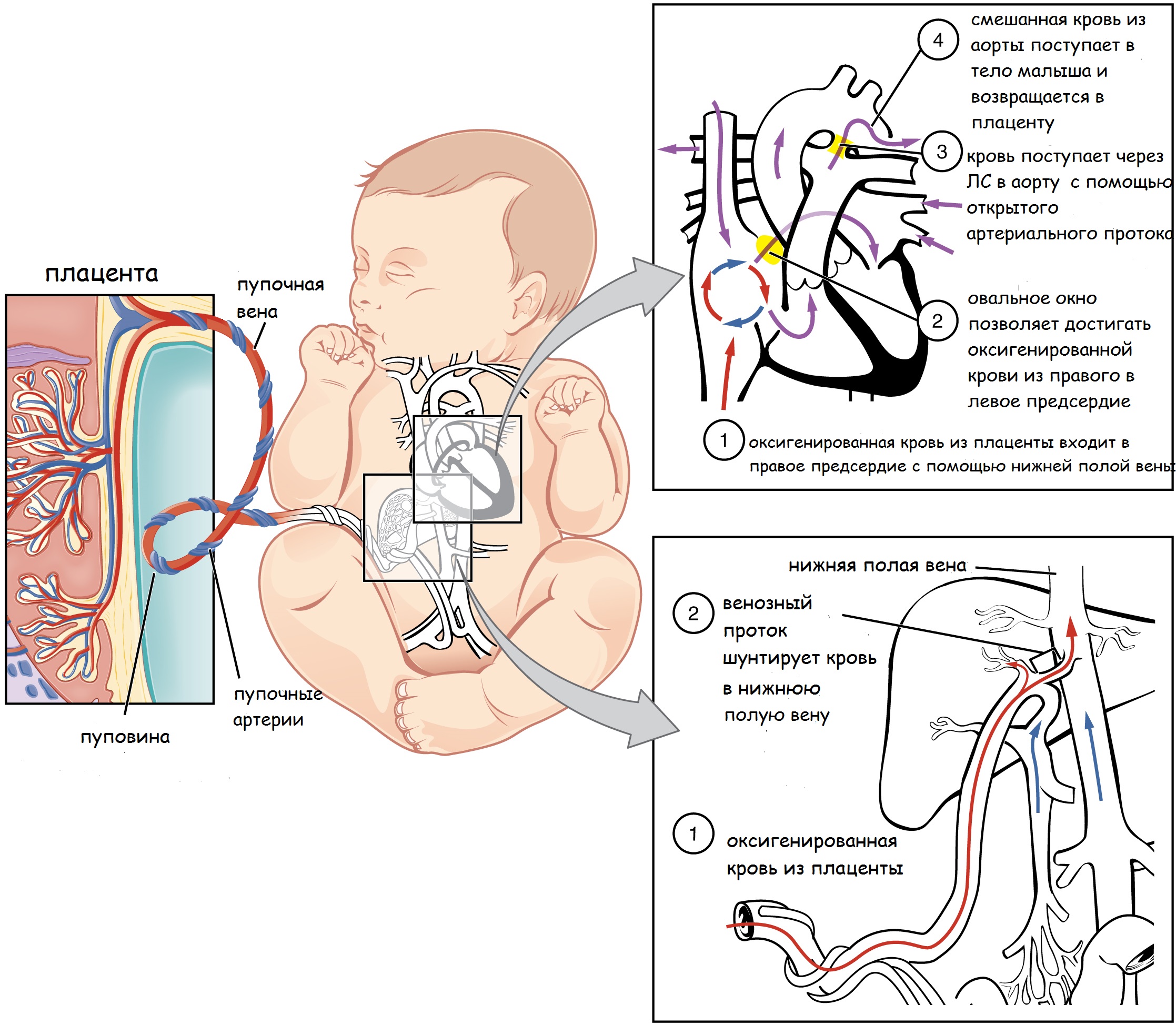
Пупочная вена из плаценты собирает богатую оксигенированную (артериальную) кровь с питательными веществами и направляет к печени, где она разделяется на 2 ветви: воротная вена и венозный проток. Воротная вена кровоснабжает органы брюшной полости (печень, кишечник и тд.).
Венозный проток – 1- фетальная коммуникация или сосуд, соединяющий пупочную вену с сердцем плода. Смешивание крови происходит на уровне нижней полой вены, она в свою очередь собирает бедную использованную кровь (венозную) из нижней части туловища.
Далее смешанная кровь направляется к правому предсердию, туда же из верхней части тела поступает венозная кровь из верхней половой вены.
Ток крови из правого предсердия в правый желудочек делится на 2 пути, связанные с отсутствием дыхания малыша.
Первый путь начинается с поступления крови из правого предсердия в правый желудочек и далее в лёгкие с помощью легочного ствола, который разделяет на правое и левое легкие свои ветви.
Так как альвеолы не производят газообмен и заполнены жидкостью (происходит системный спазм всех артериол), где 1/3 часть крови возвращается через легочные вены в левое предсердие.
Второй путь: оставшаяся 2/3 часть крови вынуждена поступать через такие фетальные коммуникации, как овальное окно и артериальный проток.
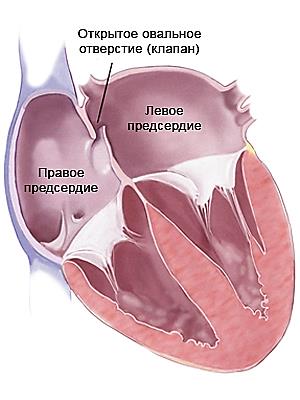
Овальное окно – 2 – фетальная коммуникация представляет собой отверстие с клапаном между предсердиями. Поступившая смешанная кровь в левое предсердие притекает в левый желудочек и далее в аорту, где она разноситься по всем органам плода. От брюшной аорты отходят 2 пупочные артерии, отдающие кровь вновь плаценте углекислый газ и продукты жизнедеятельности плода. Важно отметить, что в плаценте кровь матери и плода ни в ком случае не смешивается, кровяные клетки матери отдают кислород и принимают «отходы» от кровяных клеток малыша.
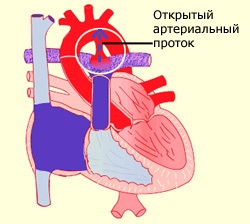
Артериальный проток – 3 – фетальная коммуникация или сосуд соединяющий легочный ствол (ЛС) с аортой, где кровь сбрасывается в аорту.
Учитывая такой сложный и многоэтапный механизм развития сердечно-сосудистой системы, различного рода воздействия на организм беременной в эмбриональном и раннем плодовом периодах могут приводить к возникновению широкого спектра врожденных аномалий этой системы. И об этом мы поговорим в следующей статье.
Источник
Изучив этот раздел, вы сможете: – Описать эмбриональное развитие сердечных структур; – Определить пять отделов сердца плода; – Соотносить структуры сердца плода и взрослого. Человеческое сердце – первый орган из формирующихся в эмбриогенезе. Оно начинает биться и перекачивать кровь уже на 21 или 22 день, всего через три недели после оплодотворения. Это подчеркивает решающее значение сердца в распространении крови по сосудам и жизненно необходимом обмене питательных веществ, кислорода и продуктов жизнедеятельности, в том числе и у развивающегося в утробе матери ребенка. Раннее развитие сердца начинается с появления выпуклости на передней поверхности эмбриона. Сердце формируется из эмбриональной ткани, называемой мезодерма, около 18-19 дня после оплодотворения. Мезодерма – один из трех первичных зародышевых листков, имеющихся уже на ранних стадиях развития и в совокупности приводящих к образованию всех последующих тканей и органов. Сердце начинает развиваться ближе к головному концу эмбриона в так называемой кардиогенной области. После под действием химических сигналов (факторов) энтодермы (еще один из трех первичных зародышевых листков) в кардиогенной области начинают формироваться две нити – кардиогенные шнуры. По мере развития шнуров внутри них быстро образуется просвет. В этот момент они называются уже эндокардиальными трубками. Трубки мигрируют вместе и сливаются в одну первичную сердечную трубку. Первичная сердечная трубка быстро образует пять различных отделов. Сверху вниз это: артериальный ствол, сердечная луковица, первичный желудочек, первичное предсердие и венозный синус. Изначально вся венозная кровь поступает в венозный синус, и сокращения заставляют кровь двигаться снизу вверх, или от венозного синуса к артериальному стволу. Такая картина очень разнится с кровообращением взрослого. Рисунок. Развитие человеческого сердца. Эта диаграмма описывает эмбриональное развитие человеческого сердца в течение первых восьми недель и последующее образование четырех камер сердца. В пяти отделах первичной сердечной трубки из едва узнаваемых образований формируется полноценное развитое сердце. Артериальный ствол в конечном итоге разделяется на восходящую аорту и легочный ствол. Сердечная луковица развивается в правый желудочек. Из первичного желудочка образуется левый желудочек. Первичное предсердие становится передней частью правого и левого предсердий, а также формирует ушки предсердий. Венозный синус развивается в заднюю часть правого предсердия, синоатриальный узел и коронарный синус. Когда первичная сердечная трубка удлиняется, она начинает складываться внутри перикарда и в конечном счете образует S-форму, которая заставляет камеры и основные сосуды принять расположение, аналогичное сердцу взрослого. Этот процесс происходит между 23 и 28 днями. Дальнейшее формирование сердца включает развитие в нем перегородок и клапанов, а также ремоделирование уже имеющихся камер. Разделение предсердий и желудочков межпредсердной перегородкой, межжелудочковой перегородкой и атриовентрикулярной перегородкой завершается к концу пятой недели, хотя имеющееся у плода овальное окно закрывается незадолго до рождения или вскоре после него. Атриовентрикулярные клапаны образуются между пятой и восьмой неделями внутриутробного развития, полулунные клапаны образуются между пятой и девятой неделями. Оригинал: https://courses.candelalearning.com/anatomyphysiology/chapter/chapter-19-the-cardiovascular-system-the-heart-2/ Перевод: Даня Ряскина Георгий Борисов
Источник
Итак, новая жизнь зародилась. Хотели вы того, или нет, желанен ли плод вашей любви или нет – это уже неважно. Яйцеклетка, образовавшаяся в яичнике, прошла трубы, осела в слизистой матки, приняла и слилась со сперматозоидом. Это уже – оплодотворенная яйцеклетка, которая будет расти и со временем станет вашим ребенком.
Эта жизнь, пока еще только одна клетка, несет в себе всю информацию, заключенную в ваших генах, т.е. мельчайших молекулах белка, и в генах вашего партнера. К этому мы еще вернемся. Но вот, клетки слились, и в первые две недели после зачатия начинаются процессы образования клеточных систем, которые затем превратятся в ткани и органы.
Как написал когда-то удивительный поэт Дмитрий Кедрин:
«Еще тошноты и пятен даже в помине нету.
И пояс твой так же узок, хоть в зеркало посмотри.
Но ты по неуловимым, по тайным женским приметам
Испуганно догадалась, что у тебя внутри…»
Вначале новая жизнь имеет форму диска. Иногда такой маленький белковый диск можно увидеть в желтке разбитого куриного яйца. Он называется эмбрион и в первые дни – это просто скопление мудрых клеток, которые точно знают, что им надо делать. С каждым последующим часом клеток становится все больше. Они соединяются и складываются в определенные формы, образуя вначале две трубки, потом, сливаясь, одну. Эта трубка, складываясь и опускаясь вниз из первичного диска, образует петлю, которая называется «первичной сердечной петлей». Петля быстро удлиняется, значительно опережая рост и увеличение числа окружающих ее клеток, ложится вправо, в виде такого кольца, как кольцо швартового каната, которое забрасывают на кнехт при причаливании катера или судна. Эта петля ложится в норме только справа, в противном случае будущее сердце будет лежать не слева, а справа от грудины. И вот на 22-й день после зачатия в утолщенном нижнем отделе петли происходит первое сокращение. Сердце начало биться. Можно попытаться вспомнить, что было тогда с будущей матерью. В каком она была состоянии? Что с ней происходило? И, если вы, как подавляющее большинство семейных и несемейных пар не уделяли этому внимания, я могу поручиться – вы не вспомните. Вы скажете: «Ну и что?», – и будете правы. Как правило, ничего. Но – все же, задумайтесь об этом. Первые дни, возможно, ничего не решают. Но последующие решат многое.
Сердечно-сосудистая система плода формируется первой из всех его систем, потому что плод нуждается в собственном кровообращении для полноценного развития других своих органов. Развитие и формирование сердечно-сосудистой системы начинается на третьей неделе и, в основном, заканчивается к восьмой неделе жизни эмбриона, т.е. происходит в течение пяти недель.
Мы опишем вкратце эти этапы, но сейчас зададимся вопросом: «Что такое сегодня 4-5 неделя беременности?». Женщина еще не уверена, беременна ли, особенно, если не слишком ждет этого события. Она не меняет своего образа жизни, привычек, иногда вредных. Она может работать на тяжелом и вредном производстве или делать тяжелую физическую работу дома. Она может перенести на ногах вирусную инфекцию в виде гриппа. Обычно пара пока не думает, старается не думать о будущем, а оно – это будущее – уже не только живет, но и бьется, сокращается, растет. Но подождите казнить себя – могут быть и другие причины. О них – позже. А пока запомним: сегодня в мире считают, что жизнь ребенка начинается не с момента его рождения, а с момента зачатия.
Итак, на 22-й день будущее сердце начинает пульсировать, а на 26-й день в организме плода, длина которого 3 миллиметра, начинается самостоятельная циркуляция крови. Таким образом, к концу четвертой недели у плода имеется сокращающееся сердце и кровообращение. Пока это – один поток, одна изогнутая трубочка, в изгибе которой залегает «моторчик» – сердце. Но ежеминутно в нем происходят процессы, которые ведут к окончательному формированию. Очень важно понять, что эти процессы текут одновременно в трехмерном пространстве и для того, чтобы «все правильно и точно сошлось», нужна их полная синхронизация. Больше того, если этого не случилось, т.е. в какой-то момент что-то не соединилось там, где нужно, рост и развитие сердца не прекращаются. Все идет своим чередом. Ведь когда в оркестре какой-нибудь музыкант сыграет вдруг фальшивую ноту, все равно оркестр доиграет симфонию. Но фальшивый звук улетит и забудется, да и мало кто обратит на него внимание, а формирующееся сердце – запомнит. И вот уже растущей перегородке некуда прикрепиться, или клапану – не на чем удержаться. Так образуются врожденные пороки. Для того, чтобы сердце стало четырех-, а не двухкамерным (как на третьей неделе), надо, чтобы выросли его перегородки (межпредсердная и межжелудочковая), чтобы общий артериальный ствол разделился на аорту и легочную артерию, чтобы внутри общего желудочка произошло его разделение на правый и левый, чтобы аорта соединилась с левым желудочком, чтобы полностью сформировались сердечные клапаны. Все это происходит в период между 4-й и 8-й неделей беременности, (в это время длина плода достигает всего 3,5-4 см). К концу второго месяца беременности у «дюймового» (3,5 см) эмбриона все уже сформировано. Очевидно, что чем раньше в этом процессе произошло нарушение нормального развития – тем больше сердце оказывается деформированным, т.е. тем тяжелее его врожденный порок. Чем позже это произошло, тем меньшим будет структурное изменение и тем легче можно будет порок исправить в будущем.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. Сердце ребенка. Книга для родителей о врожденных пороках сердца
Возврат к списку
Источник
 В структуре младенческой смертности аномалии развития занимают третье место, и половину случаев летальности определяют врожденные пороки сердца (ВПС). Среди детей, умерших от ВПС и пороков развития крупных сосудов, 91% пациентов – это младенцы первого года жизни, из них 35% летальных исходов приходятся на ранний неонатальный период (до 6 дней). Около 70% детей умирают в течение первого месяца жизни [3, 4].
В структуре младенческой смертности аномалии развития занимают третье место, и половину случаев летальности определяют врожденные пороки сердца (ВПС). Среди детей, умерших от ВПС и пороков развития крупных сосудов, 91% пациентов – это младенцы первого года жизни, из них 35% летальных исходов приходятся на ранний неонатальный период (до 6 дней). Около 70% детей умирают в течение первого месяца жизни [3, 4].
Масштаб проблемы подчеркивает высокая частота ВПС: в разных странах этот показатель варьирует от 0,6% до 2,4% в год у детей, родившихся живыми, с учетом внутриутробной гибели плода и ранних выкидышей общая частота ВПС составляет 7,3% [1, 3].
Пренатальная диагностика. С целью снижения младенческой смертности используется пренатальный ультразвуковой скрининг, позволяющий выявить большинство ВПС до 24-й недели гестации. При подозрении на порок проводится прицельное УЗИ плода на аппарате экспертного класса. Основная задача – предотвратить рождение детей с неоперабельными пороками – синдромом гипоплазии левого сердца (СГЛС), гипертрофической кардиомиопатией с признаками органического поражения миокарда, множественными пороками развития плода. Пренатальный консилиум должен предложить прерывание беременности только при условии точной диагностики некурабельного порока [2, 4].
Классификация. В периоде новорожденности (иногда в первые дни, часы или минуты после рождения) манифестируют пороки, называемые критическими, так как они в 95-100% случаев сопровождаются жизнеугрожающими состояниями и определяют раннюю неонатальную летальность. К группе критических пороков относят транспозицию магистральных сосудов (ТМС), СГЛС, атрезию трикуспидального клапана или легочной артерии с интактной межжелудочковой перегородкой (МЖП), предуктальную коарктацию аорты, общий артериальный ствол, единственный желудочек, двойное отхождение магистральных сосудов от правого желудочка и другие [1, 5].
Учитывая высокую летальность новорожденных детей и младенцев от ВПС, для данной возрастной группы пациентов создана классификация, основанная на определении ведущего клинического синдрома, эффективности терапевтической тактики и определяющая сроки хирургического вмешательства [3, 4].
Синдромальная классификация ВПС у новорожденных и детей первого года жизни (Шарыкин А. С., 2005)
ВПС, проявляющиеся артериальной гипоксемией (хроническая гипоксемия, гипоксемический статус) – «дуктус-зависимые» пороки.
ВПС, преимущественно проявляющиеся сердечной недостаточностью (острая сердечная недостаточность, застойная сердечная недостаточность, кардиогенный шок).
ВПС, проявляющиеся нарушениями ритма сердца (полная атриовентрикулярная блокада, пароксизмальная тахикардия).
Данные состояния могут сочетаться, усугубляя тяжесть состояния детей, 50% этих детей требуют хирургического или терапевтического вмешательства на первом году жизни.
Гемодинамика. Критические пороки характеризуются дуктус-зависимым легочным или системным кровообращением, их объединяет внезапное резкое ухудшение внешне благополучного при рождении ребенка, связанное с уменьшением кровотока через артериальный проток. Дуктус-зависимое легочное кровообращение при ТМС, атрезии (или критическом стенозе легочной артерии) с интактной МЖП обеспечивает кровоток через проток в малый круг кровообращения, и при его ограничении или прекращении развивается тяжелая артериальная гипоксемия, острая гипоксия органов и тканей.
Клиника ВПС с легочным дуктус-зависимым кровообращением
Анатомия одного из самых частых критических пороков – транспозиции магистральных сосудов – заключается в неправильном отхождении аорты – из правого и легочной артерии – из левого желудочка, что способствует разобщению кругов кровообращения: в системе малого круга циркулирует артериальная кровь, в системе большого круга – венозная.
 Поступление кислорода к жизнеобеспечивающим органам возможно только при условии функционирующих фетальных коммуникаций – артериального протока, межпредсердного дефекта. Данное сообщение между кругами кровообращения не обеспечивает компенсации гипоксемии. С целью компенсации дефицита периферического кровообращения увеличивается минутный объем кровотока, возникает перегрузка малого круга (это происходит быстрее при наличии дефекта МЖП), быстро развивается легочная гипертензия. Именно поэтому в ходе ведения больного необходим постоянный контроль симптомов артериальной гипоксемии и мониторинг клинических признаков сердечной недостаточности (СН) – табл. 1.
Поступление кислорода к жизнеобеспечивающим органам возможно только при условии функционирующих фетальных коммуникаций – артериального протока, межпредсердного дефекта. Данное сообщение между кругами кровообращения не обеспечивает компенсации гипоксемии. С целью компенсации дефицита периферического кровообращения увеличивается минутный объем кровотока, возникает перегрузка малого круга (это происходит быстрее при наличии дефекта МЖП), быстро развивается легочная гипертензия. Именно поэтому в ходе ведения больного необходим постоянный контроль симптомов артериальной гипоксемии и мониторинг клинических признаков сердечной недостаточности (СН) – табл. 1.
Естественное течение порока очень тяжелое. Ребенок рождается в срок с нормальной массой тела, но в первые часы после рождения появляется диффузный цианоз кожи, особенно выраженный на периферии – цианоз лица, кистей, стоп. Состояние крайней степени тяжести обусловлено тяжелой артериальной гипоксемией. Одышка, тахикардия появляются через 1-2 часа после пережатия пуповины. Отмечается прогрессирующее ухудшение состояния. Ребенок вялый, заторможенный, легко охлаждается.
При закрытии фетальных коммуникаций острая гипоксия приводит к развитию полиорганной недостаточности и гибели новорожденного в течение нескольких часов. При выживании ребенка в течение нескольких недель нарастает сердечная недостаточность. Быстро развивается тяжелая гипотрофия. Необходимо отметить, что в случае адекватной тактики наблюдения и лечения, а также своевременной – до месяца – хирургической коррекции порока у ребенка (так как только в этот период возможна радикальная коррекция методом артериального переключения магистральных сосудов) полностью восстанавливается физиологическая гемодинамика, темпы роста и развития, физическая и в последующем социальная адаптация. Если коррекция порока проводится позже – исходы менее благоприятны.
Диагностические критерии ТМС включают:
Электрокардиографические признаки гипертрофии правого предсердия и правого желудочка – высокий зубец Р в «правых» отведениях – III, V1-3, глубокие зубцы S в «левых» – I, V5-6 и высокие зубцы R в отведениях III, V1-3.
Рентенологически определяется кардиомегалия и «овоидная» форма сердца с узким сосудистым пучком в результате совмещения контуров крупных сосудов (фото).
По данным эхокардиографии – параллельный ход выводных отделов желудочков – легочной артерии и аорты.
Гипероксидный тест отрицательный – при попытке подачи 100% кислорода через маску у больных с «синими» пороками через 10-15 минут рО2 возрастает не более чем на 10-15 мм рт. ст. (тогда как при болезнях легких рост рО2 составляет до 100-150 мм рт. ст.).
Схема обследования новорожденного ребенка с подозрением на ВПС:
осмотр больного (с оценкой симптомов гипоксемии и/или сердечной недостаточности);
оценка пульсации на всех конечностях;
аускультация сердца и легких (динамический контроль частоты сердечных сокращений, дыхания);
измерение артериального давления (АД) на всех конечностях (в дальнейшем динамический контроль).
Кроме того, наблюдение ребенка предполагает мониторинг газов крови (рО2, рСО2), сатурации кислорода (SatO2) с помощью пульсоксиметрии и метаболических показателей – рН, ВЕ. Газообмен в легких не нарушен, если РаО2 находится в пределах 60-80 мм рт. ст., SаО2 – 96-98%. Артериальная гипоксемия развивается при РаО2 менее 60 мм рт. ст. и уровне насыщения гемоглобина 85-75%.
Задачи педиатра (неонатолога):
обеспечить снижение потребностей организма в кислороде с помощью создания температурного и физического комфорта – условия кювеза, с возвышенным положением верхней части туловища;
пеленание со свободными грудной клеткой и руками;
ограничение энергетических затрат на физиологическую нагрузку (кормление через зонд);
поддержка кровотока через артериальный проток (инфузия жидкостей, простагландина Е);
коррекция метаболических сдвигов, при необходимости – искусственная вентиляция легких (ИВЛ) без добавления кислорода во вдыхаемую смесь, в режиме, исключающем гипервентиляцию и при одновременной инфузии препарата простагландина Е (расчет дозы препарата описан ниже). Принимая решение о назначении ИВЛ, необходимо учитывать, что кислород оказывает вазоконстрикторное влияние на артериальный проток, что делает кислородотерапию опасной в данной группе пациентов;
при угрозе закрытия дуктус-зависимых пороков объем инфузий и кормления увеличивают до 110-120% от нормальных потребностей на фоне постоянной оценки диуреза. Установлено, что прирост массы тела у новорожденного на 5% за 1-2 суток стабилизирует функцию артериального протока.
Транспортировка в кардиохирургический центр оптимальна в течение первых недель, первого месяца жизни. Предварительно необходимо сообщить в кардиохирургический стационар о больном с врожденным пороком сердца с дуктус-зависимым кровообращением. Период наблюдения до момента перевода и транспортировка в центр проводится на фоне инфузии препарата простагландина Е (Алпростан, Вазапростан).
Клиника ВПС с системным дуктус-зависимым кровообращением (группа пороков включает СГЛС, выраженную коарктацию аорты, перерыв дуги аорты). Наиболее позитивным примером пороков данной группы является выраженная предуктальная коарктация, занимающая от 1% до 10% среди критических ВПС. При данном пороке резко ограничен или полностью отсутствует кровоток из проксимальной ее части (ниже места отхождения артериального протока) к дистальной. Нарушение гемодинамики, соответственно, заключается в том, что в нисходящую аорту (в большой круг) небольшой объем крови поступает только из легочной артерии через артериальный проток. При закрывающемся артериальном протоке остро развивается гипоперфузия органов и тканей и полиорганная недостаточность. Клиника: доношенный новорожденный с резким ухудшением в первые несколько дней жизни – адинамия, холодные конечности, симптом гипоперфузии периферических тканей («белого пятна»), пульс малого наполнения, высокое АД на руках и низкое или не определяется на ногах, одышка, тахикардия, олигоурия с нарастающей азотемией, гепатомегалия с ростом трансаминаз, некротизирующий энтероколит.
Рассмотрим диагностику и оптимальную терапевтическую тактику в отношении пациента с выраженной коарктацией аорты на конкретном клиническом примере.
Доношенный новорожденный А., доставлен в реанимационное отделение в тяжелом состоянии: вялый, грудь не сосет, кожные покровы бледные, тахипноэ 120 в минуту, дыхание симметрично проводится по всем полям, хрипов нет. Тоны сердца звучные, 167 в минуту, нежный систолический шум в третьем межреберье слева от грудины, гепатомегалия (печень +5 см из-под края ребра, плотная). Диурез снижен, периферических отеков нет. АД на руках – 127/75 мм рт. ст., пульсация на бедренной артерии не определяется. SatO2 – 98%.
Из анамнеза: состояние ухудшилось внезапно на 14-е сутки жизни, когда ребенок стал вялым, появилась выраженная одышка, госпитализирован машиной «скорой помощи». Мальчик от второй, нормально протекавшей беременности, срочных родов с массой 3220 г, оценкой по шкале Апгар 5 (9) баллов. Выписан из родильного дома в удовлетворительном состоянии, находился на естественном вскармливании. Периодически отмечались эпизоды беспокойства, метеоризм.
При поступлении ребенок интубирован, проводится ИВЛ с низким содержанием кислорода во вдыхаемой смеси. Обследование в стационаре выявило кардиомегалию (кардиоторакальный индекс – 80%), обеднение легочного рисунка, по данным электрокардиографии – сочетанную перегрузку обоих желудочков. Эхокардиография установила гипоплазию аорты ниже места отхождения левой подключичной артерии (и выше локализации артериального протока), в типичном для артериального протока месте – точечный кровоток (закрывающийся артериальный проток). Через 6 часов состояние ребенка ухудшилось: развилась олигурия, отмечен рост креатинина до 213 ммоль/л, трансаминаз в 4-5 раз от уровня лабораторной нормы. Гуморальная активность не установлена.
Обоснование диагноза и тактики: учитывая клинику выраженной дыхательной и в последующем – полиорганной недостаточности в сочетании с кардиомегалией, системной артериальной гипертензией, почечной и печеночной недостаточностью, по клиническим данным следовало заподозрить коарктацию аорты. Внезапное ухудшение состояния ребенка в отсутствие признаков инфекции позволяет думать о дуктус-зависимом системном кровообращении, с учетом данных визуализации сердца и сосудов имеет место диагноз: «ВПС, предуктальная коарктация аорты, артериальная гипертензия 2 ст., вторичная, полиорганная недостаточность».
С момента подтверждения диагноза по данным ЭхоКГ необходимо начать терапию Вазапростаном 0,02 (с увеличением дозы до 0,05 мкг/кг/мин) с целью восстановления кровотока через артериальный проток. При данном пороке шунт направлен из легочной артерии в нисходящую аорту, и только эта небольшая порция крови обеспечивает весь большой круг кровообращения.
Расчет дозы и методика введения. Вес ребенка при поступлении – 3220 г. В 1 ампуле содержится 20 мкг Вазапростана. В данном случае введение препарата начали с дозы 0,02 мкг/кг/мин, то есть потребовалось 0,02 ´ 3,2 = 0,064 мкг/кг/мин. За час доза препарата составила 0,064 ´ 60 = 3,8 мкг/час. Для введения препарата 1 ампулу (20 мкг Вазапростана) развели в 20 мл физиологического р-ра (в 1 мл – 1 мкг). При отсутствии эффекта в течение двух часов доза была увеличена до 0,04-0,05 мкг/кг/мин: соответственно скорость введения препарата увеличилась до 7,6-9,5 мл/час. В данном случае был очень показателен контроль терапии – через 6 часов инфузии отмечено улучшение состояния, усиление дующего систолического шума во втором межреберье слева, увеличение размеров потока через артериальный проток по данным ЭхоКГ. Переведен на поддерживающую дозу Вазапростана – 0,01 и затем 0,005 мкг/кг/мин, которая сохранялась в течение всего периода наблюдения в педиатрическом стационаре и в ходе транспортировки при переводе в кардиохирургический стационар. В данном клиническом случае полностью отойти от ИВЛ было невозможно (учитывая тяжесть дыхательной недостаточности), на 5-й день госпитализации (19-е сутки жизни) ребенок на фоне терапии переведен в клинику им. Мешалкина, где была успешно проведена коррекция порока – формирование аортолегочного шунта.
В случаях развития сердечной недостаточности у новорожденных при пороках, сопровождающихся массивным сбросом крови в малый круг кровообращения, применяется тот же принцип мониторинга основных показателей и симптоматическая терапия:
ограничение введения жидкости по диурезу, в тяжелых случаях – до 1/3 возрастной нормы (но недопустимо ограничение жидкости до 50% от суточной физиологической потребности);
наличие объемной перегрузки требует применения диуретиков (при отечном синдроме предпочтение отдается Фуросемиду/Лазиксу в дозе 1-2 мг/кг; возможна комбинация с Верошпироном (1-3 мг/кг/сутки внутрь в 2-3 приема);
с целью купирования тахикардии (экономически невыгодный режим для миокарда и неэффективный объем для периферического кровообращения) используется Дигоксин (табл. 2).
При появлении симптомов перегрузки малого круга (аускультативно – усиление, расщепление 2-го тона на легочной артерии, на ЭхоКГ – увеличение давления в легочной артерии более 30 мм рт. ст. после шести суток жизни), а также признаков нарушения диастолической функции сердца рекомендуется применять препараты из группы ингибиторов ангиотензин-превращающего фермента (иАПФ). Используется Капотен (каптоприл) в дозе 0,5-1 мг/кг при условии контроля системного АД. Терапевтическое действие иАПФ связано со снижением периферического сопротивления сосудов и частичным депонированием крови, в результате чего уменьшается объем крови, возвращаемой в правые отделы сердца. Соответственно уменьшается объем шунта и нагрузка на левые камеры и сосуды малого круга. Кроме того, известно, что иАПФ являются ингибитором апоптоза, стимулированного гипоксией, что объясняет ангио- и кардиопротективный эффект препаратов.
Таким образом, тактика педиатра, включающая раннюю диагностику критических ВПС и терапию, управляющую внутрисердечной, центральной и периферической гемодинамикой, а также по возможности ранняя координация действий с кардиохирургическим центром способны существенно улучшить прогноз больных и уменьшить показатели младенческой смертности.
Литература
Бураковский В. А., Бухарин В. А., Подзолков В. П. и др. Врожденные пороки сердца. В кн. Сердечно-сосудистая хирургия. Под ред. В. И. Бураковского, Л. А. Бокерия. М.: Медицина, 1989; 345-382.
Врожденные пороки сердца. Справочник для врачей. Под ред. Е. В. Кривошеева, И. А. Ковалева. Томск, 2009; 285.
Шарыкин А. С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов. М.: Изд-во «Теремок», 2005; 384.
Шарыкин А. С. Перинатальная кардиология. Руководство для педиатров, кардиологов, неонатологов. М.: Изд-во «Теремок», 2007; 347.
Johnson Jr. W. H., Moller J. H. Pediatric cardiology. Core handbooks in pediatrics. LIPPUNCOTT WILLIAMS & WILKINS, 2001; 326.
Е. Ю. Емельянчик*, доктор медицинских наук, профессор
Д. Б. Дробот*, доктор медицинских наук, профессор
Е. П. Кириллова*, кандидат медицинских наук, доцент
В. А. Сакович*, доктор медицинских наук, профессор
Е. В. Басалова**
А. Ю. Черемисина*
*ГОУ ВПО Красноярский ГМУ им. профессора В. Ф. Войно-Ясенецкого,
**Краевая клиническая детская больница, Красноярск
Контактная информация об авторах для переписки: lenacor@mail.ru
Классификация СН у грудных детей с учетом проводимого лечения (А. С. Шарыкин, 2000)
Применение дигоксина у детей
Источник
